张金华教授团队构建了新型红细胞纳米酶与铁硫化物协同的复合材料抗菌促创伤修复
近日,我院张金华教授团队在国际知名的纳米生物技术领域期刊Journal of Nanobiotechnology(《纳米生物技术杂志》)发表一项重要研究成果,提出新型纳米材料感染性创面治疗新策略。我校作为第一作者单位和第一通讯单位。
该研究成果于2025年5月13日以“Comprehensive wound healing using ETN@Fe7S8 complex by positively regulating multiple programmed phases”为题,发表在Journal of Nanobiotechnology上(DOI: 10.1186/s12951-025-03396-w)。张金华教授与中科院生物物理研究所高利增研究员合作,吉林师范大学与北京交通大学联合培养硕士生陈梦霞为第一作者,张金华教授为论文的主通讯作者。
Journal of Nanobiotechnology是纳米生物技术领域的学术期刊(中科院1区,TOP期刊,影响因子:10.6),主要报道纳米技术在生物医学和生物工程中的应用和研究成果,为生物医学领域的创新和生物医学工程的发展提供了重要的支持。
复杂创面特别是耐药菌感染创面治疗,面临多重挑战。张金华教授与中科院生物物理所合作,前期研究发现,纳米材料在感染控制和组织修复方面展现出良好潜力,开发了红细胞碳纳米酶(ETN),研究成果已于2023年12月6日发表在Advanced Science上,题为“An Erythrocyte-Templated Iron Single-Atom Nanozyme for Wound Healing”。本研究在此基础上进一步构建了一种新型红细胞纳米酶与铁硫化物协同的复合材料(ETN@Fe₇S₈),实现了伤口愈合的多阶段调控与协同修复。ETN@Fe7S8通过水热法合成,以ETN为模板,负载硫化铁的纳米复合材料。ETN中丰富的Fe–N₄配位结构促进了硫化铁的稳定结合与均匀分布,赋予材料良好的结构协同性。
研究发现,该复合材料可在不依赖外部光源的条件下,通过释放Fe²⁺与多硫诱导铁死亡,强效杀灭耐甲氧西林金黄色葡萄球菌(MRSA);同时通过抑制NF-κB信号通路减轻炎症反应,并激活PI3K/AKT通路,促进血管新生与组织修复。在动物模型中,ETN@Fe₇S₈表现出优异的抗菌性、生物相容性与组织再生能力。本研究揭示了一种全新的多模式抗菌材料策略,从“抗菌—抗炎—修复”多维角度协同介入感染性创面的治疗过程,为多功能纳米材料在感染与组织再生领域的应用提供了理论基础与实践路径。

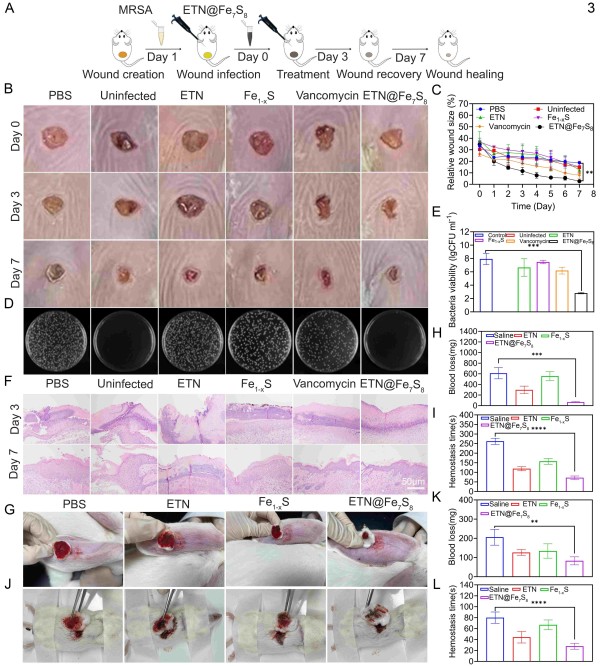
ETN@Fe7S8在MRSA感染伤口模型中具有高效抗菌、促愈合和止血功能的综合治疗效果。兔耳静脉和小鼠肝脏出血模型进一步表明其快速止血功能,有赖于ETN模板的促凝作用和铁硫化物的协同效应。
机制研究发现,ETN@Fe7S8通过调控巨噬细胞极化和NF-κB信号通路发挥抗炎作用,从而加速伤口修复。Fe2+和多硫协同抑制NF-κB磷酸化(p-p65下调),通过铁死亡机制和硫化物介导的抗炎信号通路共同促进炎症消退和组织再生。
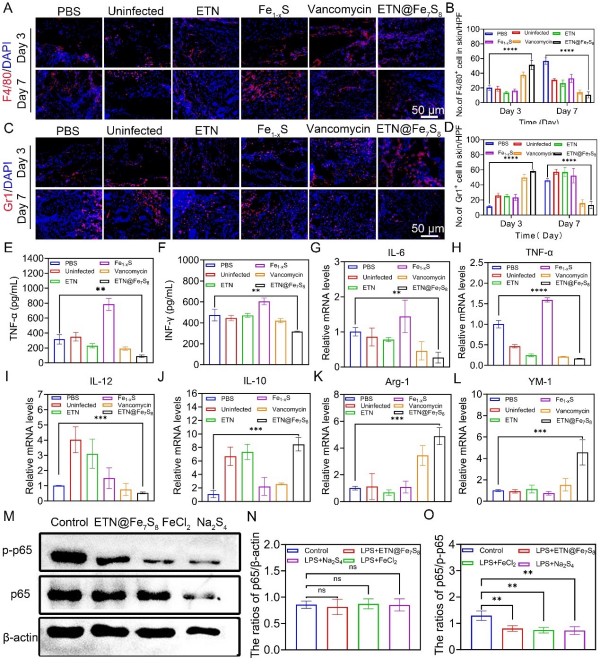
ETN@Fe7S8通过释放多硫激活PI3K/AKT通路,显著促进血管生成,全面优化伤口微环境,实现高效组织修复。

ETN@Fe7S8 可有效止血、控制感染、调节炎症反应、促进血管新生与角质形成细胞重塑,在创面愈合的各阶段均发挥关键作用。该研究为创伤修复提供了一种结构可控、功能多元的纳米酶新策略,展现出广阔的转化应用前景。
论文链接:
https://doi.org/10.1186/s12951-025-03396-w
